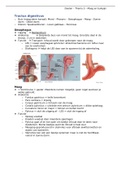
TEM A 4 :
I n t r odu cción a l e n la ce qu ím ico
Tema 4.- Introducción al enlace químico.
1. Introducción
2. Carácter metálico y enlace químico. Triángulo de van Arkel-Ketelaar.
3. Teoría de Lewis. Símbolos.
3.1. Estructuras de Lewis
3.2. Cargas formales
3.3. Resonancia
3.4. Excepciones a la regla del octete
4. Teoría de repulsión de los pares de electrones de la capa de valencia (VSEPR)
4.1. Desviaciones de la geometría ideal.
5. Moléculas polares y no polares
6. Polarizabilidad.
Qu ím ica Ge n e r a l y An a lít ica . Grado en Farmacia
Grupo 5: Lunes y Martes 15-16 h. Aula 0.3
Rosa Pe r e ñ ígu e z
TEM A 4 :
I n t r odu cción a l e n la ce qu ím ico
Objetivos
1. Conocer el por qué se da un enlace químico y la relación existente entre la
posición de un elemento en la tabla periódica y el tipo de enlace.
2. Saber escribir la estructura de Lewis de una molécula.
3. Comprender el concepto resonancia y las implicaciones que tiene sobre
conceptos como la distancia de enlace y la energía de enlace.
4. Poder deducir la estructura molecular, sabiendo diferenciarla de la estructura
electrónica.
Tema 4: Introducción al enlace químico 2
, Propiedades periódicas
Configuraciones electrónicas
Carácter metálico. Electronegatividad
Introducción al enlace químico
Estructuras de Lewis.
Geometría molecular: RPECV o VSEPR.
Orden, distancia y energías de enlace. Resonancia.
Enlaces polares y no polares.
Tratamiento mecano-cuántico del enlace: TEV y TOM
Tema 4: Introducción al enlace químico 3
1. Introducción
¿ Por qué se enlazan los átomos?
Dos átomos se enlazan si la unión resultante posee una mayor estabilidad que ambos átomos
por separado.
HH HH H H H H Interacciones:
• Los electrones son atraídos por
los dos núcleos.
• Los electrones se repelen unos
a otros.
• Los dos núcleos se repelen
entre sí.
Energía de enlace
Teoría de enlace para explicar:
-436 Distancia de enlace Propiedades de las moléculas
(energías de enlace, longitud de
74 enlace, ángulo de enlace…)
Mínimo de energía potencial: formación del enlace
Tema 4: Introducción al enlace químico 4
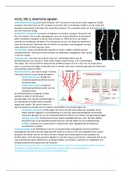
,2. Carácter metálico y enlace químico. Triángulo de van Arkel-Ketelaar
Recordemos el concepto Se define como la capacidad que tiene un átomo de un elemento para
atraer hacia sí a los electrones cuando está formando parte de un
de electronegatividad: compuesto Propiedad periódica
ENLACE METÁLICO
Posición en la T.P. Tipo de unión ENLACE IÓNICO
ENLACE COVALENTE
ENLACE METÁLICO
Los elementos electropositivos se enlazan formando
enlace metálico. Se forman redes tridimensionales.
Ejemplos:
Na, Fe, Au, K
Modelo del mar de electrones (limitaciones)
Red de centros positivos Maleabilidad
Conjunto de electrones Fuerza aplicada: deforma al metal
deslocalizados
Tema 4: Introducción al enlace químico 5
2. Carácter metálico y enlace químico. Triángulo de van Arkel-Ketelaar
ENLACE IÓNICO
Cuando un elemento electronegativo y otro electropositivo se
combinan, generalmente se forma un compuesto cristalino iónico.
Teoría de
No se identifican enlace iónico Ejemplos:
moléculas individuales q1q2 Sales: NaCl, CaCl2
Red iónica F12 = K Cerámica: MgO, ZrO2, TiO2
r122
ENLACE COVALENTE
Combinación de elementos electronegativos se enlazan
formando enlace covalentes.
Forman moléculas Ejemplos:
diferenciadas HCl, Cl2, O2,H2O
El porcentaje de ionicidad de un enlace depende de la diferencia de electronegatividad entre los átomos.
6
Tema 4: Introducción al enlace químico
, 2. Carácter metálico y enlace químico. Triángulo de van Arkel-Ketelaar
El porcentaje de ionicidad de un enlace depende de la diferencia de electronegatividad entre los átomos.
La mayoría de las
situaciones no
corresponden a
enlaces puros
Triángulo de van Arkel-Ketelaar
Iónico Alta diferencia de
Δχ Diferencia de Electronegatividades electronegatividad
χmedia Promedio de Electronegatividades
Δχ
Elementos Elementos
electropositivos electronegativos
Metálico χmedia Covalente
7
Tema 4: Introducción al enlace químico
2. Carácter metálico y enlace químico. Triángulo de van Arkel-Ketelaar
Tema 4: Introducción al enlace químico 8
I n t r odu cción a l e n la ce qu ím ico
Tema 4.- Introducción al enlace químico.
1. Introducción
2. Carácter metálico y enlace químico. Triángulo de van Arkel-Ketelaar.
3. Teoría de Lewis. Símbolos.
3.1. Estructuras de Lewis
3.2. Cargas formales
3.3. Resonancia
3.4. Excepciones a la regla del octete
4. Teoría de repulsión de los pares de electrones de la capa de valencia (VSEPR)
4.1. Desviaciones de la geometría ideal.
5. Moléculas polares y no polares
6. Polarizabilidad.
Qu ím ica Ge n e r a l y An a lít ica . Grado en Farmacia
Grupo 5: Lunes y Martes 15-16 h. Aula 0.3
Rosa Pe r e ñ ígu e z
TEM A 4 :
I n t r odu cción a l e n la ce qu ím ico
Objetivos
1. Conocer el por qué se da un enlace químico y la relación existente entre la
posición de un elemento en la tabla periódica y el tipo de enlace.
2. Saber escribir la estructura de Lewis de una molécula.
3. Comprender el concepto resonancia y las implicaciones que tiene sobre
conceptos como la distancia de enlace y la energía de enlace.
4. Poder deducir la estructura molecular, sabiendo diferenciarla de la estructura
electrónica.
Tema 4: Introducción al enlace químico 2
, Propiedades periódicas
Configuraciones electrónicas
Carácter metálico. Electronegatividad
Introducción al enlace químico
Estructuras de Lewis.
Geometría molecular: RPECV o VSEPR.
Orden, distancia y energías de enlace. Resonancia.
Enlaces polares y no polares.
Tratamiento mecano-cuántico del enlace: TEV y TOM
Tema 4: Introducción al enlace químico 3
1. Introducción
¿ Por qué se enlazan los átomos?
Dos átomos se enlazan si la unión resultante posee una mayor estabilidad que ambos átomos
por separado.
HH HH H H H H Interacciones:
• Los electrones son atraídos por
los dos núcleos.
• Los electrones se repelen unos
a otros.
• Los dos núcleos se repelen
entre sí.
Energía de enlace
Teoría de enlace para explicar:
-436 Distancia de enlace Propiedades de las moléculas
(energías de enlace, longitud de
74 enlace, ángulo de enlace…)
Mínimo de energía potencial: formación del enlace
Tema 4: Introducción al enlace químico 4
,2. Carácter metálico y enlace químico. Triángulo de van Arkel-Ketelaar
Recordemos el concepto Se define como la capacidad que tiene un átomo de un elemento para
atraer hacia sí a los electrones cuando está formando parte de un
de electronegatividad: compuesto Propiedad periódica
ENLACE METÁLICO
Posición en la T.P. Tipo de unión ENLACE IÓNICO
ENLACE COVALENTE
ENLACE METÁLICO
Los elementos electropositivos se enlazan formando
enlace metálico. Se forman redes tridimensionales.
Ejemplos:
Na, Fe, Au, K
Modelo del mar de electrones (limitaciones)
Red de centros positivos Maleabilidad
Conjunto de electrones Fuerza aplicada: deforma al metal
deslocalizados
Tema 4: Introducción al enlace químico 5
2. Carácter metálico y enlace químico. Triángulo de van Arkel-Ketelaar
ENLACE IÓNICO
Cuando un elemento electronegativo y otro electropositivo se
combinan, generalmente se forma un compuesto cristalino iónico.
Teoría de
No se identifican enlace iónico Ejemplos:
moléculas individuales q1q2 Sales: NaCl, CaCl2
Red iónica F12 = K Cerámica: MgO, ZrO2, TiO2
r122
ENLACE COVALENTE
Combinación de elementos electronegativos se enlazan
formando enlace covalentes.
Forman moléculas Ejemplos:
diferenciadas HCl, Cl2, O2,H2O
El porcentaje de ionicidad de un enlace depende de la diferencia de electronegatividad entre los átomos.
6
Tema 4: Introducción al enlace químico
, 2. Carácter metálico y enlace químico. Triángulo de van Arkel-Ketelaar
El porcentaje de ionicidad de un enlace depende de la diferencia de electronegatividad entre los átomos.
La mayoría de las
situaciones no
corresponden a
enlaces puros
Triángulo de van Arkel-Ketelaar
Iónico Alta diferencia de
Δχ Diferencia de Electronegatividades electronegatividad
χmedia Promedio de Electronegatividades
Δχ
Elementos Elementos
electropositivos electronegativos
Metálico χmedia Covalente
7
Tema 4: Introducción al enlace químico
2. Carácter metálico y enlace químico. Triángulo de van Arkel-Ketelaar
Tema 4: Introducción al enlace químico 8