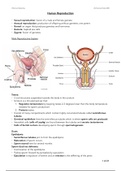
1. Botsingstheorie
Of een reactie verloopt wordt bepaald door de thermodynamica (ΔG < 0) én de kinetica (reactiesnelheid). Factoren
zoals p, T, [reagentia], [reactieproducten] en vreemde agentia zijn geen onderdeel van de reactie, maar hebben wel
invloed op de snelheid.
Botsing: bewegingsenergie trillings-energie. Als de trillings-energie > de activeringsenergie (EA) dan worden de
oude bindingen van het molecuul verbroken. EA is dus afhankelijk van:
1. De botsingsfrequentie
a. Daalt bij reactie met meerdere moleculen.
b. Complexe reacties met meerdere moleculen vaak de som van elementaire reacties
samengestelde reactie.
2. Het aantal moleculen dat bij een botsing genoeg energie heeft
3. De sterische factor (waarschijnlijkheid van “juiste” botsing)
2. Reactiesnelheid
𝑑 𝑐𝑜𝑛𝑐𝑒𝑛𝑡𝑟𝑎𝑡𝑖𝑒
Reactiesnelheid = (𝑑 = 𝑣𝑒𝑟𝑎𝑛𝑑𝑒𝑟𝑖𝑛𝑔)
𝑑 𝑡𝑖𝑗𝑑
De fysische reactiesnelheid is hetzelfde voor de versch. stoffen binnen een reactie, maar de snelheid waarmee de
stoffen veranderen kan verschillen afhankelijk van de concentratie.
Bijv. 2 N2O5 (g) 4 NO2 (g) + O2 (g)
Δ(𝑁2 𝑂5 ) Δ(𝑁𝑂2 ) Δ(𝑂2 )
− = 2 × 𝑉𝑁2 𝑂5 + = 4 × 𝑉𝑁2 𝑂5 + = 𝑉𝑂2 𝑚𝑒𝑡 |𝑉𝑁2 𝑂5 | = |𝑉𝑁𝑂2 | = |𝑉𝑂2 |
Δ𝑡 Δ𝑡 Δ𝑡
1 𝑑(𝑁2 𝑂5 ) 1 𝑑(𝑁𝑂2 ) 𝑑(𝑂2 )
𝑉𝑁2 𝑂5 = − × 𝑉𝑁𝑂2 = + × 𝑉𝑂2 = +
2 𝑑𝑡 4 𝑑𝑡 𝑑𝑡
3. De orde van een reactie
De reactiesnelheid is onder andere afhankelijk van de concentraties van de reagentia. De snelheidsvergelijking:
1 𝑑(𝐴1 )
𝑉𝐴1 = − × = 𝑘 × 𝑓((𝐴1 ), (𝐴2 ), … )
𝑣1 𝑑𝑡
v1 = stoichiometrie k = reactiesnelheidsconstante (cte bij cte T)
De functie wordt experimenteel bepaald en is meestal: 𝑓((𝐴1 ), (𝐴2 ), … ) = (𝐴1 )𝛼 , (𝐴2 )𝛽 , …
α en β zijn de partiële ordes van de respectievelijke reagentia A1 en A2. De orde van een reactie is σ = α + β + … De
stoichiometrische orde is v1 + v2 + … Regel van Van ’t Hoff: bij een elementaire reactie is de orde gelijk aan de
stoichiometrische orde (dus α = v1 en β = v2):
1 𝑑(𝐴1 ) 𝑘
𝑉𝐴1 = − × = 𝑘 (𝐴1 )𝑣1 , (𝐴2 )𝑣2 … 𝑏𝑖𝑗𝑣. 2𝐴 → 𝐵 𝑉𝐴 = 𝑘(𝐴)2
𝑣1 𝑑𝑡
Bepalen van de orde
𝑘
𝐴 + 𝐵→𝐶
1 (𝑑𝐴) 1 (𝑑𝐵)
De algemene snelheidsvergelijking: 𝑉𝐴 = − 1 × 𝑑𝑡
= 𝑘 (𝐴)𝛼 (𝐵)𝛽 = − 1 × 𝑑𝑡
= 𝑉𝐵
De beginsnelheid wordt gemeten bij verschillende beginconcentraties A en B.
Experiment nr. (A)0 in M (B)0 in M Beginsnelheid in M/s
1 0,030 0,010 1,7×10-8
2 0,060* 0,010 6,8×10-8
3 0,030 0,020* 4,8×10-8
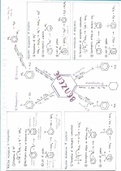
,Experiment 1 vs. experiment 2
(A)0 verdubbeld, (B)0 blijft constant, de beginsnelheid verviervoudigd: 4 = (2.0)α α = 2
𝑉𝐶1 = 𝑘 (𝐴1 )𝛼 (𝐵1 )𝛽 𝑉𝐶2 = 𝑘 (𝐴2 )𝛼 (𝐵1 )𝛽
𝑉𝐶1 𝑘 (𝐴1 )𝛼 (𝐵1 )𝛽 𝑉𝐶1 𝐴1 𝛼
= =( ) 𝛼 𝑒𝑛𝑖𝑔𝑒 𝑜𝑛𝑏𝑒𝑘𝑒𝑛𝑑𝑒
𝑉𝐶2 𝑘 (𝐴2 )𝛼 (𝐵1 )𝛽 𝑉𝐶2 𝐴2
Experiment 1 vs. experiment 3
(A)0 blijft constant, (B)0 verdubbeld, de beginsnelheid veranderd met 2.83: 2.83 = (2.0)β β = 3/2
𝑉𝐶1 = 𝑘 (𝐴1 )𝛼 (𝐵1 )𝛽 𝑉𝐶3 = 𝑘 (𝐴1 )𝛼 (𝐵2 )𝛽
𝑉𝐶1 𝑘 (𝐴1 )𝛼 (𝐵1 )𝛽 𝑉𝐶1 𝐵1 𝛽
= =( ) 𝛽 𝑒𝑛𝑖𝑔𝑒 𝑜𝑛𝑏𝑒𝑘𝑒𝑛𝑑𝑒
𝑉𝐶3 𝑘 (𝐴1 )𝛼 (𝐵2 )𝛽 𝑉𝐶3 𝐵2
Snelheidsvergelijking: 𝑉𝐴 = 𝑘 (𝐴)2 (𝐵)3/2
𝑉 1.7×10−8 𝑀/𝑠 1.7×10−8 𝑀 𝑠 −1
𝐴
Snelheidsconstante: 𝑘 = (𝐴)2 (𝐵) 3/2 = (0.030𝑀)2 ×(0.010𝑀)3/2 = = 1.9 × 10−2 𝑀−5/2 𝑠 −1
(0.0302 ×0.0103/2 ) 𝑀 2+3/2
Controle: experiment 1, 2 en 3 zouden dezelfde k-waarden moeten geven.
4. De invloed van temperatuur
De reactiesnelheid stijgt me toenemende temperatuur.
𝐴 𝐸𝑎
ln 𝑘 = 𝐵 − 𝐴= 𝐴 𝑒𝑛 𝐵 = 𝑐𝑡𝑒, 𝐸𝑎 = 𝑑𝑒 𝑎𝑐𝑡𝑖𝑣𝑒𝑟𝑖𝑛𝑔𝑠𝑒𝑛𝑒𝑟𝑔𝑖𝑒, 𝑅 = 𝑑𝑒 𝑔𝑎𝑠𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒
𝑇𝑎𝑏𝑠 𝑅
5. Enkele reactietypes
Nulde orde reactie
𝐴 𝑡
𝑘 (𝑑𝐴)
𝐴→𝐷 ∶ 𝑉𝐴 = − =𝑘 𝑑(𝐴) = −𝑘 𝑑𝑡 ∫ 𝑑(𝐴) = −𝑘 ∫ 𝑑𝑡 𝐴 − 𝐴0 = −𝑘(𝑡 − 𝑡0 ) 𝐴 = 𝐴0 − 𝑘𝑡
𝑑𝑡
𝐴0 𝑡0
𝑚𝑒𝑒𝑠𝑡 𝑛𝑢𝑡𝑡𝑖𝑔𝑒 𝑣𝑜𝑟𝑚 𝑣𝑜𝑜𝑟 𝑏𝑒𝑟𝑒𝑘𝑒𝑛𝑖𝑛𝑔𝑒𝑛 → (𝐴)𝑡 = −𝑘𝑡 + (𝐴)0
(A) versus t geeft een dalende rechte: de helling geeft de snelheidsconstante k (negatief), het snijpunt met de y-as
(bij t=0) geeft (A)0. De halveringstijd:
𝐴0 𝐴0 𝐴0 𝐴0
= 𝐴0 − 𝑘𝑡1/2 → 𝑘𝑡1/2 = 𝐴0 − = → 𝑡1/2 = 𝐴0 𝑖𝑠 𝑣𝑎𝑟𝑖𝑎𝑏𝑒𝑙, 𝑘 𝑖𝑠 𝑐𝑡𝑒 → 𝒕𝟏/𝟐 𝒊𝒔 𝒗𝒂𝒓𝒊𝒂𝒃𝒆𝒍
2 2 2 𝑘2
Eerste orde reactie
𝐴 𝑡
𝑘 (𝑑𝐴) 𝑑(𝐴)
𝐴 → 𝐵 + 𝐶 ∶ 𝑉𝐴 = − = 𝑘(𝐴)1 = −𝑘 𝑑𝑡 ∫ 𝑑 𝑙𝑛(𝐴) = −𝑘 ∫ 𝑑𝑡 𝑙𝑛𝐴 − 𝑙𝑛𝐴0 = −𝑘(𝑡 − 𝑡0 )
𝑑𝑡 (𝐴)
𝐴0 𝑡0
→ 𝑙𝑛𝐴 − 𝑙𝑛𝐴0 = −𝑘𝑡 → 𝑙𝑛𝐴 = 𝑙𝑛𝐴0 − 𝑘𝑡 → A = A0 𝑒 −𝑘𝑡
𝑚𝑒𝑒𝑠𝑡 𝑛𝑢𝑡𝑡𝑖𝑔𝑒 𝑣𝑜𝑟𝑚 𝑣𝑜𝑜𝑟 𝑏𝑒𝑟𝑒𝑘𝑒𝑛𝑖𝑛𝑔𝑒𝑛 → ln(𝐴) = −𝑘𝑡 + 𝑙𝑛(𝐴)0
ln(A) versus t geeft een dalende rechte: de helling geeft de snelheidsconstante k (negatief), het snijpunt met de y-as
(bij t=0) geeft log(A)0. De halveringstijd:
𝐴0 𝑙𝑛2 0,693
𝑙𝑛 = ln 𝐴0 − 𝑘𝑡1/2 → 𝑙𝑛𝐴0 − 𝑙𝑛2 = 𝑙𝑛𝐴0 − 𝑘𝑡1/2 → 𝑡1/2 = → 𝑡1/2 = 𝑘 𝑖𝑠 𝑐𝑡𝑒 → 𝒕𝟏/𝟐 𝒊𝒔 𝒄𝒕𝒆
2 𝑘 𝑘
Tweede orde reactie
𝐴 𝑡
𝑘 𝑑(𝐴) 𝑑(𝐴) 1
𝐴 → 𝐵 + 𝐶 ∶ 𝑉𝐴 = − = 𝑘(𝐴)2 = −𝑘 𝑑𝑡 𝑑(𝐴) = −𝑘 𝑑𝑡 ∫(𝐴)−2 𝑑(𝐴) = −𝑘 ∫ 𝑑𝑡
𝑑𝑡 (𝐴)2 (𝐴)2
𝐴0 𝑡0
, 1 1 1 1 1 1
−2(𝐴)−1 − (−2𝐴0 )−1 = −𝑘(𝑡 − 𝑡0 ) → −2 − (−2 ) = −𝑘𝑡 → − = −𝑘 𝑡 → − =𝑘
(𝐴) (𝐴)0 𝐴0 𝐴 𝐴 𝐴0
1 1
→ = +𝑘𝑡
𝐴 𝐴0
1 1
𝑚𝑒𝑒𝑠𝑡 𝑛𝑢𝑡𝑡𝑖𝑔𝑒 𝑣𝑜𝑟𝑚 𝑣𝑜𝑜𝑟 𝑏𝑒𝑟𝑒𝑘𝑒𝑛𝑖𝑛𝑔𝑒𝑛 → = 𝑘𝑡 +
𝐴 𝐴0
1/(A) versus t geeft een stijgende rechte: de helling geeft de snelheidsconstante k (positief), het snijpunt met de y-as
(bij t=0) geeft 1/(A)0. De halveringstijd:
1
𝐴0 1 2 1 1 1
= + 𝑘𝑡1/2 → − = 𝑘𝑡1/2 → = 𝑘𝑡1/2 → 𝑡1/2 = 𝐴 𝑖𝑠 𝑣𝑎𝑟𝑖𝑎𝑏𝑒𝑙, 𝑘 𝑖𝑠 𝑐𝑡𝑒 → 𝒕𝟏/𝟐 𝒊𝒔 𝒗𝒂𝒓𝒊𝒂𝒃𝒆𝒍
2 𝐴0 𝐴0 𝐴0 𝐴0 𝑘 𝐴0 0
Gelijktijdige/competitieve reacties (1e orde)
𝑘1 𝑑(𝐵) 𝑘2 𝑑(𝐶)
𝐴→𝐵 ∶ = 𝑘1 (𝐴) 𝐴→𝐶 ∶ = 𝑘2 (𝐴)
𝑑𝑡 𝑑𝑡
𝐴 𝑡
𝑑(𝐴) 𝑑(𝐴) −1
− = 𝑘1 𝐴 + 𝑘2 𝐴 = 𝐴(𝑘1 + 𝑘2 ) = −(𝑘1 + 𝑘2 )𝑑𝑡 ∫(𝐴) 𝑑(𝐴) = −(𝑘1 + 𝑘2 ) ∫ 𝑑𝑡
𝑑𝑡 (𝐴)
𝐴0 𝑡0
𝑙𝑛𝐴 − 𝑙𝑛𝐴0 = −(𝑘1 + 𝑘2 )𝑡 → 𝐴 = A0 𝑒 −(𝑘1 +𝑘2 )𝑡
𝐴 𝐴
𝑑(𝐵) −(𝑘1 +𝑘2 )𝑡
= 𝑘1 𝐴 𝑑(𝐵) = 𝑘1 𝐴 𝑑𝑡 𝑑(𝐵) = 𝑘1 ∫ A0 𝑒 𝑑𝑡 = 𝑘1 A0 ∫ 𝑒 −(𝑘1 +𝑘2 )𝑡 𝑑𝑡
𝑑𝑡
𝐴0 𝐴0
𝑘1 𝑘2 𝐵 𝑘1
𝐵= 𝐴 𝑒 −(𝑘1 +𝑘2 )𝑡 𝐶= 𝐴 𝑒 −(𝑘1 +𝑘2 )𝑡 → =
−(𝑘1 + 𝑘2 ) 0 −(𝑘1 + 𝑘2 ) 0 𝐶 𝑘2
Tegengestelde of evenwichtsreacties (1e orde)
k1 (𝐵)𝑒𝑣 𝑘1
𝐵 𝑚𝑒𝑡 𝐾 =
𝐴
=
𝑒𝑣
k2 (𝐴)𝑒𝑣 𝑘2
𝑘1 𝑑(𝐴) 𝑘2 𝑑(𝐵)
𝑎𝑓𝑧𝑜𝑛𝑑𝑒𝑟𝑙𝑖𝑗𝑘𝑒 𝑟𝑒𝑎𝑐𝑡𝑖𝑒𝑠 𝑏𝑒𝑠𝑐ℎ𝑜𝑢𝑤𝑡 𝐴 → 𝐵 ∶ 𝑉𝐴 = − = 𝑘1 (𝐴) 𝐵 → 𝐴 ∶ 𝑉𝐵 = − = 𝑘2 (𝐵)
𝑑𝑡 𝑑𝑡
Bij t = 0 : (A) = (A)0 en (B) = 0 (A)0 = (A) + (B) en (B) = (A)0 – (A)
𝑑(𝐴) 𝑑(𝐴) 𝑑(𝐴)
𝑏𝑒𝑖𝑑𝑒 𝑟𝑒𝑎𝑐𝑡𝑖𝑒𝑠 𝑏𝑒𝑠𝑐ℎ𝑜𝑢𝑤𝑡 𝑉𝐴 = − = 𝑘1 (𝐴) − 𝑘2 (𝐵) = −𝑘1 𝐴 + 𝑘2 𝐵 = −𝑘1 𝐴 + 𝑘2 (𝐴0 − 𝐴)
𝑑𝑡 𝑑𝑡 𝑑𝑡
𝑑(𝐴) (𝐵)𝑒𝑣 (𝐴)0 − (𝐴)𝑒𝑣
𝑏𝑖𝑗 𝑒𝑣𝑒𝑛𝑤𝑖𝑐ℎ𝑡 − = 𝑘1 (𝐴)𝑒𝑣 − 𝑘2 (𝐵)𝑒𝑣 = 0 𝑘1 (𝐴)𝑒𝑣 = 𝑘2 (𝐵)𝑒𝑣 𝑘1 = 𝑘2 = 𝑘2
𝑑𝑡 (𝐴)𝑒𝑣 (𝐴)𝑒𝑣
𝑑(𝐴) (𝐴)0 − (𝐴)𝑒𝑣
𝑠𝑢𝑏𝑠𝑡𝑖𝑡𝑢𝑡𝑖𝑒 𝑣𝑎𝑛 𝑘1 𝑏𝑖𝑗 𝑒𝑣𝑒𝑛𝑤𝑖𝑐ℎ𝑡 𝑖𝑛 𝑉𝐴 ∶ − = 𝑘2 (𝐴) − 𝑘2 (𝐴0 − 𝐴)
𝑑𝑡 (𝐴)𝑒𝑣
, 𝑘2 ((𝐴)0 − (𝐴)𝑒𝑣 )(𝐴) 𝑘2 (𝐴0 − 𝐴)(𝑨)𝒆𝒗 𝑘2 (𝐴)0 (𝐴) − 𝑘2 (𝐴)𝑒𝑣 (𝐴) − 𝑘2 (𝐴)0 (𝐴)𝑒𝑣 + 𝑘2 (𝐴)(𝐴)𝑒𝑣
= − =
(𝐴)𝑒𝑣 (𝑨)𝒆𝒗 (𝐴)𝑒𝑣
𝑘2 (𝐴)0 ((𝐴) − (𝐴)𝑒𝑣 ) 𝑑(𝐴) 𝑑(𝐴) −𝑘2 (𝐴) 0 ((𝐴) − (𝐴)𝑒𝑣 )
= =− → =
(𝐴)𝑒𝑣 𝑑𝑡 𝑑𝑡 (𝐴)𝑒𝑣
𝐴
𝑘2 (𝐴)0 𝑑(𝐴) (𝐴)0 1
=( ((𝐴)𝑒𝑣 − (𝐴))) → = −𝑘2 𝑑𝑡 ∫ 𝑑(𝐴)
(𝐴)𝑒𝑣 (𝐴) − (𝐴)𝑒𝑣 (𝐴)𝑒𝑣 (𝐴) − (𝐴)𝑒𝑣
𝐴0
𝑡
(𝐴)0 (𝐴)0
= −𝑘2 ∫ 𝑑𝑡 → ln((𝐴) − (𝐴)𝑒𝑣 ) − ln((𝐴)0 − (𝐴)𝑒𝑣 ) = −𝑘2 𝑡
(𝐴)𝑒𝑣 (𝐴)𝑒𝑣
𝑡0
(𝐴)0 (𝐴)0 − (𝐴)𝑒𝑣 (𝐴)0
→ ln((𝐴)0 − (𝐴)𝑒𝑣 ) − ln((𝐴) − (𝐴)𝑒𝑣 ) = 𝑘2 𝑡 → ln ( ) = 𝑘2 𝑡
(𝐴)𝑒𝑣 (𝐴) − (𝐴)𝑒𝑣 (𝐴)𝑒𝑣
Dit is een functie in de vorm van y = rc × x, waarbij t = x
ln (A – Aev) versus t geeft rechte: uit de helling (rc) kan de snelheidsconstante k2 berekend worden en met 𝑘1 =
(𝐵) (𝐴)0 −(𝐴)𝑒𝑣
𝑘2 (𝐴)𝑒𝑣 = 𝑘2 (𝐴)𝑒𝑣
kan k1 berekend worden.
𝑒𝑣
6. Snelheid en reactieoppervlak / aggregatietoestand
Reacties in homogene systemen (bv. oplossingen) zijn meestal sneller dan in heterogene systemen, omdat de stoffen
gemakkelijker “bereikbaar” zijn. Heterogene reacties kunnen enkel plaatsgrijpen thv de grensoppervlakken.
Aangezien het contactoppervlak van een constante hoeveelheid stof toeneemt bij een kleinere deeltjesgrootte,
zullen kleinere deeltjes sneller reageren.
7. Katalysatoren
Homogene en heterogene katalysatoren
Katalysatoren zijn stoffen die de reactie sneller laten verlopen zonder dat ze daarbij zelf worden opgebruikt. Ze
veranderen de samenstelling van het evenwichtsmengsel niet. Soms wordt de katalysator gevormd tijdens de reactie
(autokatalyse). Inhibitoren remmer/vertragen een reactie. Dit kan nadelig of voordelig zijn, bv. het afremmen van
tandbederf of voedselbederf (antioxidantia).
Werking
Katalysatoren verlagen de activeringsenergie. Ze worden niet opgebruikt in de reactie, maar kunnen wel deelnemen
aan tussenreacties (intermediaire stof).
Homogene katalyse