Estructura molecular
Introducción
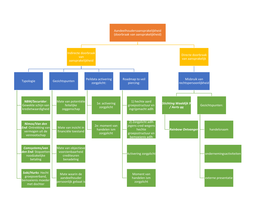
ESTRUCTURA MOLECULAR
TEORÍA CLASIFICACIÓN
CLÁSICA CUÁNTICA Covalente
•Kossel •T.O.M. Iónico
•Lewis •T.E.V. Metálico
Objetivos:
Combinación de los átomos
Geometría y energías moleculares
Fortaleza de los enlaces
Hibridación, resonancia, enlaces múltiples, polaridad, etc...
Estructura de los sólidos
Química I - Tema 3 1
, Enlace covalente
Teoría de Lewis
Concepto: * Los electrones que están en la capa de valencia
juegan un papel fundamental en el enlace químico.
* El enlace covalente se produce por la compartición electrónica
para formar el “octeto de Lewis” (enlaces sencillos y múltiples)
Regla del octeto: “Cuando los átomos reaccionan, tienden a conseguir
una esfera externa de ocho electrones” [Empírica, NO general]
·· ··
: F− F :
·· ··
Características:
Átomos con electronegatividades altas y similares
Densidad electrónica compartida en la zona internuclear
Los orbitales que intervienen deben de estar semiocupados
Es el enlace más común
Química I - Tema 3 2
, Enlace covalente
Teoría de Lewis
Enlace covalente simple
Enlace covalente múltiple
• • • • • •
O• O C O
••
• C• •O ••
••
••
•• • •• •• • ••
• • • •• ••
O C O O C O
••
••
•• • •• •• ••
Química I - Tema 3 3
, Enlace covalente
Teoría de Lewis
Reglas de Lewis para la formulación de estructuras:
1. Determinar el número de electrones de valencia
2. Identificar el átomo o átomos centrales (suelen ser los menos electronegativos) El
hidrógeno siembre es un átomo terminal
3. Dibujar un esqueleto estructural adecuado y unir los átomos mediante enlaces sencillos.
4. Descontar los electrones de enlace y colocar el octeto a los átomos externos, los sobrantes
sobre el central
5. Para completar el octeto del átomo central, ceder pares de los externos para formar
enlaces covalentes múltiples
Ejemplo: C2N2
Paso 1. n = 4 + 4 + 5 + 5 = 18 electrones Paso 5.
Paso 2. NCCN N=C-C=N
Paso 3 N-C-C-N
Paso 4 18 – 6 = 12 electrones N≡C-C≡N
N-C-C-N
Química I - Tema 3 5
Introducción
ESTRUCTURA MOLECULAR
TEORÍA CLASIFICACIÓN
CLÁSICA CUÁNTICA Covalente
•Kossel •T.O.M. Iónico
•Lewis •T.E.V. Metálico
Objetivos:
Combinación de los átomos
Geometría y energías moleculares
Fortaleza de los enlaces
Hibridación, resonancia, enlaces múltiples, polaridad, etc...
Estructura de los sólidos
Química I - Tema 3 1
, Enlace covalente
Teoría de Lewis
Concepto: * Los electrones que están en la capa de valencia
juegan un papel fundamental en el enlace químico.
* El enlace covalente se produce por la compartición electrónica
para formar el “octeto de Lewis” (enlaces sencillos y múltiples)
Regla del octeto: “Cuando los átomos reaccionan, tienden a conseguir
una esfera externa de ocho electrones” [Empírica, NO general]
·· ··
: F− F :
·· ··
Características:
Átomos con electronegatividades altas y similares
Densidad electrónica compartida en la zona internuclear
Los orbitales que intervienen deben de estar semiocupados
Es el enlace más común
Química I - Tema 3 2
, Enlace covalente
Teoría de Lewis
Enlace covalente simple
Enlace covalente múltiple
• • • • • •
O• O C O
••
• C• •O ••
••
••
•• • •• •• • ••
• • • •• ••
O C O O C O
••
••
•• • •• •• ••
Química I - Tema 3 3
, Enlace covalente
Teoría de Lewis
Reglas de Lewis para la formulación de estructuras:
1. Determinar el número de electrones de valencia
2. Identificar el átomo o átomos centrales (suelen ser los menos electronegativos) El
hidrógeno siembre es un átomo terminal
3. Dibujar un esqueleto estructural adecuado y unir los átomos mediante enlaces sencillos.
4. Descontar los electrones de enlace y colocar el octeto a los átomos externos, los sobrantes
sobre el central
5. Para completar el octeto del átomo central, ceder pares de los externos para formar
enlaces covalentes múltiples
Ejemplo: C2N2
Paso 1. n = 4 + 4 + 5 + 5 = 18 electrones Paso 5.
Paso 2. NCCN N=C-C=N
Paso 3 N-C-C-N
Paso 4 18 – 6 = 12 electrones N≡C-C≡N
N-C-C-N
Química I - Tema 3 5