Resume
Samenvatting 'Moleculaire biologie' Deeltoets 1
- Cours
- Établissement
- Book
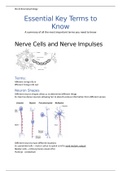
Deze samenvatting bevat alle belangrijkste punten van het vak moleculaire biologie (B-B1MB05). Alle onderdelen zijn ordelijk onder elkaar uitgezet en worden kort maar krachtig toegelicht om efficiënt te leren. De samenvatting komt voort uit: aantekeningen, werkcolleges, leerdoelen en teksten uit...
[Montrer plus]