Resume
Samenvatting instrumentele analyse
- Cours
- Instrumentele analyse
- Établissement
- Thomas More Hogeschool (tmhs)
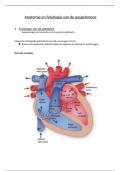
Samenvatting van het vak instrumentele analyse dat gegeven wordt in het 2de jaar agro- en biotechnologie.
[Montrer plus]
Les clients de Stuvia ont évalués plus de 700 000 résumés. C'est comme ça que vous savez que vous achetez les meilleurs documents.

Vous pouvez payer rapidement avec iDeal, carte de crédit ou Stuvia-crédit pour les résumés. Il n'y a pas d'adhésion nécessaire.

Vos camarades écrivent eux-mêmes les notes d’étude, c’est pourquoi les documents sont toujours fiables et à jour. Cela garantit que vous arrivez rapidement au coeur du matériel.
Vous obtenez un PDF, disponible immédiatement après votre achat. Le document acheté est accessible à tout moment, n'importe où et indéfiniment via votre profil.
Notre garantie de satisfaction garantit que vous trouverez toujours un document d'étude qui vous convient. Vous remplissez un formulaire et notre équipe du service client s'occupe du reste.
Stuvia est une place de marché. Alors, vous n'achetez donc pas ce document chez nous, mais auprès du vendeur yduijsters. Stuvia facilite les paiements au vendeur.
Non, vous n'achetez ce résumé que pour €10,49. Vous n'êtes lié à rien après votre achat.
4.6 étoiles sur Google & Trustpilot (+1000 avis)
65040 résumés ont été vendus ces 30 derniers jours
Fondée en 2010, la référence pour acheter des résumés depuis déjà 15 ans