Samenvatting
Samenvatting BIAG23 Materialen - Les 2 - Algemeen
- Vak
- Materialen
- Instelling
- Katholieke Universiteit Leuven (KU Leuven)
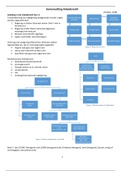
In dit bestand vindt men zowel een samenvatting van de gegeven teksten in de les Materialen, alsook notities vanuit de les.
[Meer zien]