3: macromoleculen
Celbiologie I: hoofdstuk 3 macromoleculen
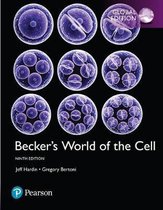
Basisstructuur van aminozuren
Aminozuren = bouwstenen van eiwitten
Carboxylgroep
Aminogroep
Waterstof
Restgroep (bepaald het aminozuur)
2 stereo-isomeren van elk aminozuur: D-aminozuur (draaien rechts) en L-aminozuur
(draaien Links)
Carboxylgroep bindt met waterstof (amidebinding condensatie van water)
N-terminus (kant van aminogroep) & C-terminus (kant van carboxylgroep)
Aminozuren
Hydrofobe aminozuren (restgroep is hydrofoob)
Glycine (restgroep is H dus geen stereo-isomeer) GLY
Proline (restgroep buigt en hangt aan aminogroep (= iminogroep) PRO
Alanine, valine, leucine, isoleucine, methionine, phenylalanine, tryptofaan
ALA, VAL, LEU, ILE, MET, PHE, TRP
Hydrofiele aminozuren (restgroep is hydrofiel)
Serine, threonine, cysteine, tyrosine, asparagine, glutamine
SER, THR, CYS, TYR, ASN, GLN
Geladen aminozuren (restgroep is geladen)
Zuren (met OH-)
Aspartaat en glutamaat ASP , GLU
Basen (met NH2+)
Lysine, arginine, histidine LYS, ARG, HIS
Eiwitstructuren
Primaire structuur
Interketen (binding in polypeptide) & intraketen (binding tussen polypeptiden)
Bv. zwavelbruggen (stabiliseren maar geen drijvende kracht)
Zwavelbrug tussen 2 zwavelatomen van cysteïnes
Secundaire structuur
-helix
Rechtsdraaiende stabiele structuur (meestal hydrofoob)
Waterstofbruggen tussen NH en CO
Restgroepen zitten naar buiten
-streng
in de plooien zitten koolstof en in de vlakken aminogroepen