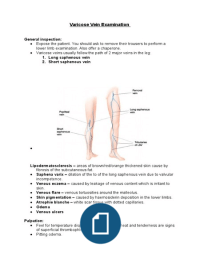
Eigenschappen van moleculen:
Ze verschillen in grootte, maar ook de grootste moleculen zijn onzichtbaar
klein
Ze verschillen sterk in massa
Ze trekken elkaar aan: soms zwak, soms sterk
Ze bewegen vrij tussen andere moleculen door (gas), ze trillen en glijden
tegen en langs elkaar (vloeistof), of ze trillen rond een vaste plek (vaste stof)
Hoe warmer de stof, hoe sneller de moleculen bewegen.
Deeltjeseigenschappen:
Alle stoffen bestaan uit deeltjes: atomen en moleculen.
Moleculen zijn opgebouwd uit atomen. Ruim 100 verschillende soorten
atomen (elementen)
Alle atomen zijn ongeveer even groot
Er zijn zware en lichte atomen. Of iets zwaar of licht is hangt af van de
dichtheid.
Zware atomen hebben een zwaardere kern.
De dichtheid van een stof wordt vooral bepaald door de massa’s van de
atomen.
De dichtheid van een stof is de massa per volume-eenheid:
P is de dichtheid (in kg/m3)
m is de massa (in kg)
V het volume (in m3)
Stollen: Bij lagere temperatuur gaan moleculen langzamer bewegen, bij 0 C zo
traag dat molecuul vaste plek heeft gekregen. (IJS)
Smelten: Als de moleculen boven de 0 C komen gaan ze sneller bewegen en dus
smelten, de moleculen in waterdruppels blijven bij elkaar doordat ze elkaar
aantrekken.
Verdampen: Als je water verwarmt gaan de moleculen steeds sneller bewegen.
Bij 100 C zo snel dat ze van elkaar loskomen. De moleculen bewegen nu vrij door
de ruimte (waterdamp)
Hoge druk: In afgesloten ruimte gasmoleculen botsen voortdurend overal tegen
aan.
Bij hogere temperatuur bewegen ze sneller en botsen vaker en harder,
hierdoor neemt de druk toe.
, 3.2 Deeltjes model:
Eigenschappen van gassen / deeltjesmodel van een gas:
Een ideaal gas bestaat uit kleine deeltjes met tussen die deeltjes lege
ruimte.
De temperatuur van een gas is een maat voor de gemiddelde snelheid van
de deeltjes
Hoe hoger de temperatuur des te groter is de gemiddelde snelheid van de
deeltjes
De temperatuur is een maat voor de bewegingsenergie van de deeltjes
De druk van een gas wordt verklaard door botsingen van de deeltjes van
het gas tegen de wand.
Met een barometer kan je de druk meten
Met een manometer kan je het drukverschil meten
Gasdruk:
De gasdruk: is de kracht (F) die het gas per m2 (A) op een wand uitoefent. De
eenheid van de druk is N/m2 of pascal (Pa).
De gasdruk hangt af van de hoeveelheid gas, het volume en de temperatuur.
Verband druk en temperatuur:
Bij het verwarmen van een gas neemt de druk toe doordat de deeltjes
harder en vaker tegen de wand botsen.
Hoe hoger de temperatuur, hoe hoger de druk
Het verband tussen de druk van een afgesloten hoeveelheid gas en de temperatuur
(graden Celsius) is lineair
De grotere druk van een gas bij hogere temp wordt verklaard, doordat de deeltjes
van het gas dan vaker en harder tegen de wand botsen.
Verband druk en volume
Bij samenpersen van een gas neemt de druk toe doordat er meer en vaker
deeltjes tegen de wand botsen.
Meer deeltjes per m3 betekent per seconde meer deeltjes tegen de wand botsen,
waardoor de kracht op de band groter is. evenredig verband tussen het aantal
deeltjes per m3 en de druk van een gas)
De druk van een afgesloten hoeveelheid gas is dus omgekeerd evenredig met het
volume. (Hoe lager het volume hoe groter de druk)